重点实验室丁俊军团队发现CTCF通过相分离调控染色质长距离互作的非经典模型
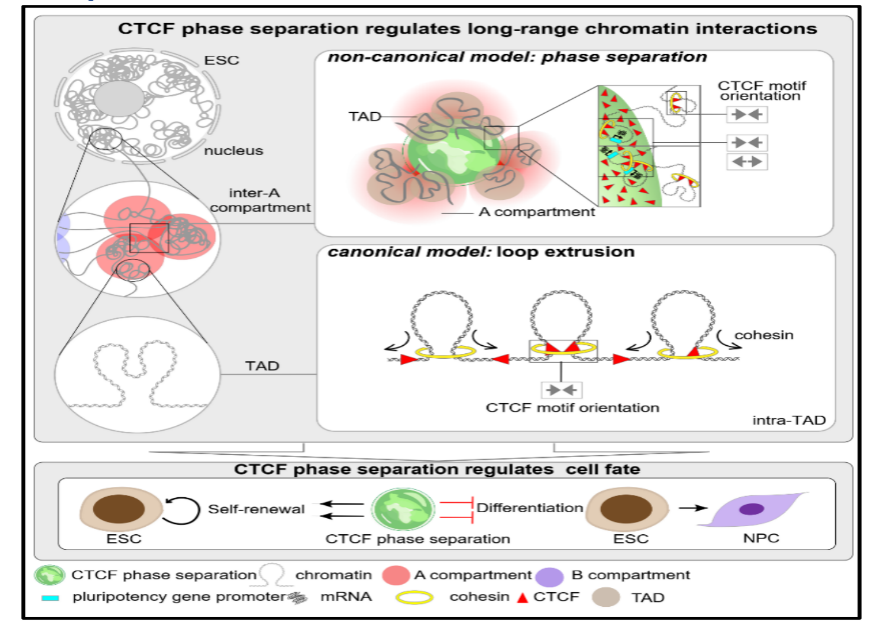
真核细胞中的染色体通常会在空间上折叠成有序的三维结构,包括区室(compartment)、拓扑相关结构域(Topological-Associated Domain, TAD)及染色质环(chromatin loop)等。这些结构广泛参与基因的表达调控,而结构异常则会导致发育异常甚至是肿瘤的发生。Compartment之间的互作在细胞命运转变过程中也会发生动态的变化。“环挤压”模型是目前被广泛认可的解释染色质是如何折叠的经典模型,但其仅可解释染色质环及拓扑相关结构域这些相对短距离的染色质之间互作的形成过程。对于Compartment之间这种长距离的染色质互作是通过什么因子以及通过什么机制形成的,仍缺乏解释。
CTCF是经典的“环挤压”模型中的重要结构因子,参与介导cohesin在DNA上的驻留从而形成染色质环。2022年6月29日,重点实验室丁俊军团队与北京大学的李程团队在Cell Research上发表了题为“CTCF organizes inter-A compartment interactions through RYBP-dependent phase separation”的文章,首次发现CTCF除了介导经典的环挤压模型调控短距离染色质互作,还可以通过非经典的相分离模型介导长距离的A compartment之间的互作。
在该项研究中,研究人员首先分析了CTCF的HiChIP数据,发现CTCF广泛参与A compartment之间的长距离互作。但CTCF敲除后会减弱A compartment之间的互作,预示着CTCF可能以一种独立于“环挤压”模型的方式介导A compartment之间的互作。随后,通过敲除RYBP的方式,进一步证明了CTCF通过相分离的方式调控A compartment之间的互作。
为了证实了CTCF相分离可参与干细胞多能性调控。在胚胎干细胞中,通过敲除RYBP破坏CTCF相分离,大量临近A compartment之间互作anchor的基因下调,且下调的基因富集在细胞增殖相关通路上。增殖实验结果表明,CTCF相分离维持干细胞的自我更新,并抑制其向神经祖细胞分化。进一步研究,发现RYBP依赖的CTCF相分离与Polycomb body存在着明显的差异。
综上所述,该研究首次揭示了CTCF具有调控compartment之间长距离互作的新功能,并提出了CTCF通过RYBP依赖的相分离的方式调控染色质长距离互作的新模型。同时揭示了操控CTCF的相分离可调控胚胎干细胞多能性,从而在compartment层级上,填补了染色质三维结构是如何形成的重要理论空白。
中山大学干细胞与组织工程教育部重点实验室丁俊军教授与北京大学李程研究员是这一研究成果的共同通讯作者,中山大学的魏超博士、博士生黄小娜和谭瑾及北京大学的贾璐萌博士为该研究成果的共同第一作者。
原文链接://doi.org/10.1038/s41422-022-00676-0

