曾园山教授团队关于改变视神经的细胞外基质可逆转其抑制神经再生的组织微环境的研究在《Biomaterials》发表
成年动物的中枢神经再生还有困难吗? 2020年干细胞与组织工程教育部重点实验室曾园山教授团队发现改变视神经的细胞外基质可逆转其抑制神经再生的组织微环境。相比于周围神经再生,中枢神经损伤后的再生涉及一系列更为复杂的微环境与细胞内信号调控机制。如何优化受损伤组织微环境并提高神经移植物的结构仿生性,是利用组织工程原理修复中枢神经损伤的主要策略和急需攻克的难题。自体周围神经或去细胞周围神经移植物因其结构仿生性和较低的免疫原性被用于修复周围神经,并取得了良好的疗效。中枢神经移植物在理论上也具有很好的结构仿生性,但因其具有强烈的抑制神经再生微环境而较少被作为修复神经损伤的天然生物材料。因此,优化中枢神经组织微环境可以为组织工程神经移植物修复中枢神经损伤提供新思路。
2020年8月10日,曾园山教授团队在国际TOP期刋Biomaterials(中科院一区,IF=10.273)上在线发表了题为Decellularization optimizes the inhibitory microenvironment of the optic nerve to support neurite growth的研究成果。该论文共同第一作者为博士生孙佳慧和副研究员李戈博士;曾园山教授为通讯作者。
该研究发现,脱细胞技术逆转了成年猪视神经抑制神经再生的微环境,使其更接近于胚胎猪视神经的细胞外基质成份,优化了视神经的功能,使之支持背根神经节(DRG)神经突起直行生长。在去细胞视神经(DON)纵切厚片上的神经突起生长距离显著长于生长在正常视神经(ON)纵切厚片上的神经突起。与ON相比,生长在DON上的神经突起分支也明显增加。应用蛋白组学技术分析了成年猪视神经、去细胞猪视神经和胚胎猪视神经三种细胞外基质成份,发现去细胞视神经的蛋白成份有转向胚胎化的趋势:脱细胞技术选择性去除一些抑制神经突起生长分子,如髓鞘相关糖蛋白(MAG)和硫酸软骨素蛋白多糖(CSPGs)等,并保留了支持神经突起生长的蛋白成份,包括四型胶原(COL4)和层粘连蛋白(LAM)等。位于DON纵切厚片结缔组织隔膜上的COL4和LAM被证明与DRG神经突起上的整合素α1(ITGA1)结合,是导致神经突起直行生长的因素之一。该研究为优化中枢神经组织微环境向有利于神经再生的功能转变提供了可行的技术路径,也为DON作为天然生物支架在神经损伤修复中的应用奠定了理论基础。
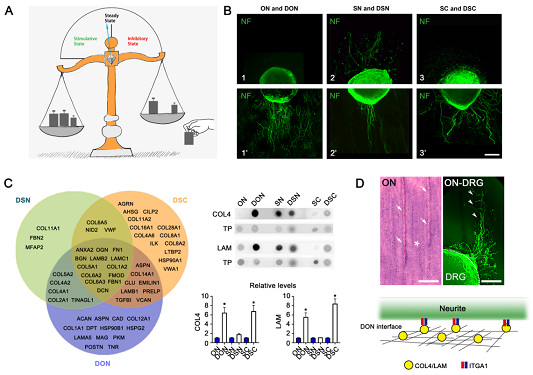
图:脱细胞技术逆转了成年猪视神经抑制神经再生的微环境
论文链接://www.sciencedirect.com/science/article/pii/S0142961220305354

