重点实验室王金凯课题组通过系统生物学方法揭示RNA结合蛋白广泛参与m6A RNA甲基化的特异性调控
真核细胞的m6A RNA修饰是一种广泛存在的可逆的动态修饰,是mRNA中含量最丰富的非末端修饰。近年来,大量的研究揭示了m6A的甲基转移酶和去甲基化酶的表达异常导致的关键基因的m6A RNA修饰的变化的在各种生理和病理过程中发挥了重要作用。然而甲基化酶和去甲基化酶造成的m6A整体水平的变化通常难以实现对不同的靶基因的精细调控,也难以形成细胞特异的甲基化模式。目前已有包括miRNA、转录因子和H3K36me3组蛋白修饰和RNA结合蛋白被报道参与了m6A的特异性调控。然而特异性调控是否是一个普遍的机制,是否能够建立细胞特异的甲基化模式仍然不清楚,领域内对这些问题存在不小的分歧。与m6A不同,RNA选择性剪接的特异性调控研究得非常成熟,数量众多的剪接因子结合到特定的可变剪接位点附近调控该剪接的发生,细胞通过特异性地表达这些剪接因子从而在细胞中建立特定的剪接模式。那么是否也存在大量的RNA结合蛋白特异性地结合在RNA特定位点促进或抑制m6A甲基转移酶和去甲基化酶的结合,并通过这些蛋白的细胞特异性表达建立细胞特定的m6A甲基化模式?
2020年2月,我重点实验室王金凯课题组在Nucleic Acids Research上发表了题为“Integrative network analysis identifies cell-specific trans regulators of m6A”的论文,建立了一套基于m6A共甲基化网络的计算框架来系统地鉴定细胞特异的m6A反式调控因子(论文第一作者为王金凯课题组的安三奇、黄万旭和黄翔)。作者通过对目前公开的25个不同的细胞系的104个m6A-seq、上百个RNA结合蛋白的CLIP-seq数据和识别序列的系统性整合最终鉴定出32个特异性调控m6A的RNA结合蛋白。并对3个HepG2细胞系特异的m6A的调控因子中的两个成功进行了实验验证。揭示了大量RNA结合蛋白很可能通过特异性调控m6A参与建立细胞特异的m6A甲基化模式。
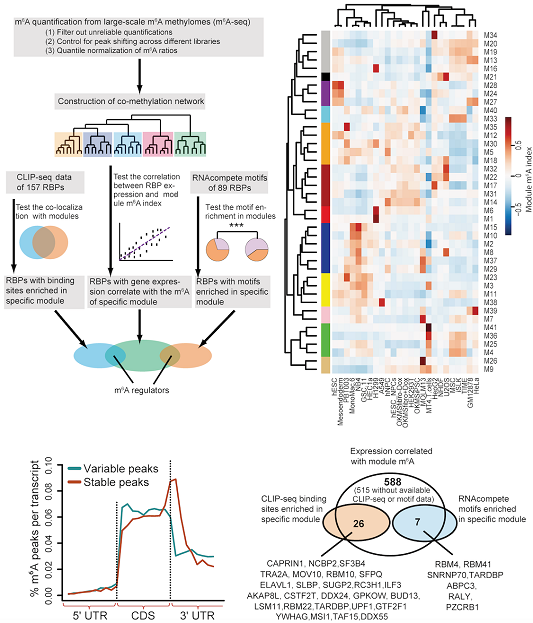
图:分析流程与主要结果
原文链接://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkz1206/5698140

