JEM | 徐涛团队揭示TCR信号可以通过诱导STAT3磷酸化促进TH17细胞分化
TH17细胞是一类能够分泌白介素17(IL-17)、白介素17F (IL-17F)和白介素22(IL-22)的CD4+辅助性T细胞。TH17细胞在清除粘膜屏障处的病原体过程中具有重要的保护性作用,但过量的TH17细胞在多种自身免疫性疾病中发挥着重要的致病性作用。目前针对诱导TH17细胞的细胞因子阻断抗体,以及针对TH17细胞分泌的细胞因子的抗体都已经在临床获批。但抗体药物昂贵,而JAK的抑制剂有较大的副作用,临床研究表明,接受JAK抑制剂治疗的患者,很容易引起其它患者自身携带病毒性疾病的复发,比如肝炎病毒、疱疹病毒的复发等等。因此亟待研发更安全、更有效的自身免疫性疾病的治疗方式。
CD4+T细胞亚群的分化具有共同的特征,即都需要抗原刺激信号(TCR signal,1st signal),共刺激信号(co-stimulation signal, 2nd signal)和细胞因子信号(cytokine signal, 3rd signal)。目前,国内外的经典免疫学教科书中都认为,TCR信号和共刺激信号促进了T细胞的激活和增殖,是所有T细胞亚群分化的前提条件,然而TCR信号并不能决定T细胞的分化方向,相反细胞因子信号则决定了CD4+T分化为何种T细胞亚群。
2024年2月7日,博彩公司排名-博彩公司评级 徐涛教授团队在Journal of Experimental Medicine上在线发表了题为“TCR signaling induces STAT3 phosphorylation to promote TH17 cell differentiation”的研究。
该研究通过多种方法发现TCR刺激可以通过下游信号Lck/Fyn直接磷酸化STAT3,并与细胞因子信号(IL-6/IL-23)协同作用,最大程度地激活STAT3,进而促进TH17细胞分化。使用Lck/Fyn的选择性小分子抑制剂(Srci1)或通过致病性STAT3突变破坏Lck/Fyn和STAT3之间的相互作用,能够选择性抑制TCR刺激诱导的STAT3激活和TH17细胞分化,并将其转化为FOXP3+ Treg细胞,进而显著改善TH17细胞介导的EAE疾病的严重程度。该研究揭示了TCR-Lck/Fyn-STAT3轴能够选择性调控TH17细胞分化,是TH17细胞相关的自身免疫性疾病潜在的治疗靶点,率先报道了TCR信号能够参与决定T细胞的分化方向。
研究人员首先通过胞内流式染色和Western blot的方法,检测多种T细胞分化培养条件下STAT3的磷酸化状态,结果显示单独细胞因子(IL-6/IL-1β/IL-23)的作用仅在Y705位诱导中等水平的STAT3磷酸化。令人惊讶的是,TCR单独刺激能够直接诱导STAT3磷酸化,TCR和细胞因子信号同时存在能够诱导最佳的STAT3磷酸化状态,表明细胞因子和TCR信号对活化STAT3具有协同作用。进一步,研究人员发现使用Lck/Fyn激酶抑制剂(Srci1),可以选择性抑制由TCR-Lck/Fyn而非由细胞因子-JAK激酶诱导的STAT3磷酸化。使用JAK激酶抑制剂(ruxolitinib, baricitinib)或IL-6/IL-21/IL-23/gp130等中和抗体均不能抑制TCR刺激诱导的STAT3的磷酸化。研究人员进一步发现Lck/Fyn 能够直接结合STAT3,并在激酶活性试验中证明了Lck能够直接磷酸化STAT3。ChIP-qPCR的结果显示,Srci1的处理几乎完全消除了活化的STAT3与Rorc、Il17、Il17f、Il23r和Il21的结合,这表明Lck/Fyn在磷酸化STAT3并招募至TH17信号基因位点的过程中发挥了重要作用。
为了研究TCR-Lck/Fyn诱导的STAT3磷酸化在TH17分化过程中的作用,研究人员在不同T细胞分化条件下添加Srci1并进行流式和qPCR检测,结果表明使用Srci1抑制Lck/Fyn活性能够剂量依赖性地抑制TH17细胞分化,促进FOXP3+Treg细胞分化,并选择性降低了TH17细胞中Rorc、Il23r、Il21、Il17a和Il17f的mRNA表达,但不影响Stat3的表达,并促进Foxp3的表达。此外,过表达组成性活化的STAT3C可以逆转Srci1对TH17细胞分化的抑制作用,这表明Srci1确实通过抑制Y705位STAT3的磷酸化来抑制TH17细胞分化。这些数据共同支持TCR-Lck/Fyn轴诱导的STAT3磷酸化对TH17细胞分化至关重要。通过RNA-seq分析,研究人员系统地评估了抑制Lck/Fyn激酶活性对TH17细胞分化的影响,发现抑制Lck/Fyn激酶活性显著影响TH17细胞分化过程中STAT3靶基因的表达。
接下来,为了研究STAT3如何被Lck/Fyn激酶直接激活,研究人员利用AlphaFold-Multimer进行预测,发现Lck/Fyn的SH2结构域而非SH3结构域与STAT3的保守区域(328-335位氨基酸_MAS motif)能相互作用。更有趣的是,STAT3保守区域的突变(Dup328–330,R335W)会导致常染色体显性高IgE综合征,这是一种与TH17分化缺陷和反复发生的葡萄球菌脓肿和粘膜皮肤病相关的疾病。免疫共沉淀(Co-IP)实验表明这些突变降低了STAT3和Lck/Fyn之间的相互作用。通过往STAT3C中引入这些突变进行TH17分化的实验,研究人员发现在STAT3保守区域的突变会中断其与Lck/Fyn的SH2结构域相互作用,并影响激酶结构域更“开放”的构象变化,改变其对Y705位磷酸化STAT3的局部激酶活性,从而影响TH17的分化。
为了进一步确定MAS motif是否是TCR刺激诱导的STAT3磷酸化所选择性需要的,研究人员用来自STAT3条件性敲除小鼠的LSK细胞,通过过继转移至T,B细胞缺陷小鼠(Rag1-/-)体内的方式,培育了含有WT Stat3或含有MAS基序突变(dup 328–330,R335W)的嵌合体小鼠。待骨髓重建成功后分离CD4+ naive T细胞并在不同的分化条件下进行培养,实验结果证实了MAS motif与Lck/Fyn的SH2结构域相互作用并增加其局部激酶活性,从而选择性影响TCR刺激诱导的STAT3磷酸化的假设。当给培养细胞加入细胞可渗透性多肽时,结果表明加入WT STAT3多肽能够通过增加STAT3磷酸化促进TH17细胞分化。这些数据共同表明,MAS motif是TCR-Lck/Fyn轴诱导STAT3磷酸化所选择性需要的,这对调控TH17细胞分化至关重要。
最后,研究人员通过在EAE模型小鼠中注射Srci1,和过继转移模型两种方法证明了TCR-Lck/Fyn-STAT3轴在TH17细胞分化中的关键作用,抑制该轴显著改善了小鼠EAE疾病的严重程度,为针对TH17相关自身免疫疾病的治疗提供了一种新策略。
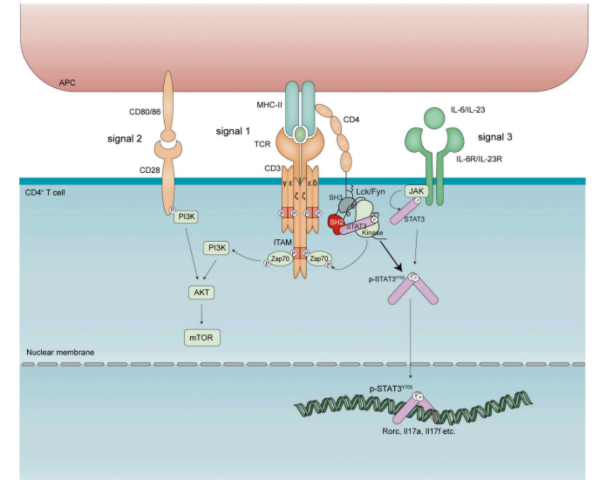
这项研究证实了TCR信号能够参与决定T细胞的分化方向,更新了在TH17细胞分化过程中只有促炎细胞因子才能激活STAT3的传统认识,揭示了TCR-Lck/Fyn轴可以直接磷酸化STAT3,并与细胞因子信号(IL-6/IL-23)协同诱导STAT3磷酸化,从而为TH17细胞相关的疾病治疗提供了全新的靶点。
博彩公司排名-博彩公司评级 徐涛教授为本文唯一通讯作者,博士生秦榛和博士后王芮宁为本文的共同第一作者。中山大学计算机学院的杨跃东教授和袁乾沐博士为本研究提供了重要的技术支持。本研究受到国家重点研发计划,国家自然科学基金,广东省引进创新创业团队,中山大学启动资金等项目资助。
原文链接://doi.org/10.1084/jem.20230683



